Шинкарев В.М. О «кочующих» ошибках
Шинкарёв В.М. О «кочующих» ошибках // Фiзiка: праблемы выкладання. – 2001. – № 1. – С. 10-29.
С переходом на новое содержание образования, его обновлением важно обратить внимание на повторяющиеся в различных изданиях учебников, в методической литературе разных авторов методические, научные ошибки, или даже сознательные заблуждения. Достаточно их и в новых белорусских учебниках природоведения и физики. Так что тема «Кочующие ошибки» может быть очень современной и крайне полезной для обсуждения. Предлагаю на эту тему обширный материал с продолжением.
1. Природа без человека?
2. Тело или вещество?
Нередко в учебной литературе при употреблении понятий «тело» и «вещество» нет должного четкого различения их смысла. С чем это связано?
Тело и вещество иногда выражаются одними и теми же словами: вода, соль, сахар, лед, железо и т.д. Нужно иметь в виду, что когда мы говорим о предмете природы, занимающем в пространстве определенный объем в конкретное время, то это тело. Примеры: стакан воды, ложка соли, кусок сахара.
Когда же по смыслу речь идет именно о составе тела, то имеется в виду, конечно же, вещество. Примеры: В стакане находилась вода. Железо тоже плавится. Или: Вкусная вода из родника. Понятно, что в последней серии примеров выделенные слова обозначают вещество.
При этом не все четко осознают, что воздух есть не вещество, а смесь различных газообразных веществ. Поэтому строить фразу с использованием выражения «молекулы воздуха», мягко говоря, не совсем корректно. Кстати, также некорректно приводить в качестве примера вещества пластмассу. Пластмасса не является веществом; за этим названием стоит целая группа веществ!
Интересно отметить, что понятие «вещество» является такой же идеализацией, как и многие другие, вроде: точечное физическое тело, рычаг и другие так называемые простые механизмы, молекула, атом, твердое тело, жидкость, газ (и не только идеальный), материальная точка, замкнутая система, математический маятник, плоская волна и т.п. Дело в том, что идеально чистых веществ не существует, там всегда присутствует различное число примесей. В той же воде находится растворенный воздух; воздух содержится и в порах твердых тел.
3. Из чего же состоят тела, или Немного химии для физика
Как часто мы читаем и потом повторяем для учащихся: «Все газы, жидкости, твердые тела состоят из молекул!» (Это вместо того, чтобы осторожно сказать: из частиц.) Первый раз эту ложь внушаем в пропедевтическом курсе типа «Природоведение», или «Вселенная», а потом в систематических курсах физики в разделе, посвященном основным понятиям (молекулярной теории) строения вещества. Далее приводим опытные обоснования гипотезы о молекулярном (вместо дискретном) строении вещества. И подтверждаем! Таков классический подход, такова традиция, соблюдаемая многие-многие годы. Хотя всем надежно известно, что это справедливо НЕ ВСЕГДА!
Уже древние ученые признавали сложное строение тел. Однако только начиная с XVIII века стала постепенно складываться система научных представлений о строении вещества, позднее названная молекулярно-кинетической теорией. Впоследствии эти представления были развиты и дополнены и составили концептуальную основу молекулярной физики.
Понятие молекулы было введено в науку в 1860 году. Прямое экспериментальное доказательство существования молекул было получено лишь в 1906 году Ж.Перреном при изучении броуновского движения. (Не английским ботаником Броуном при наблюдении в микроскоп за мелкими взвешенными в воде частицами твердых тел в 1827 году, которые ученый поначалу считал живыми.)
Приведем одно из определений молекулы.
Молекула – это способная к самостоятельному существованию (это можно установить с помощью физических методов исследования), нейтральная по заряду наименьшая совокупность атомов, связанных вследствие химического взаимодействия в определенном порядке (т.е. обладающая определенной структурой), не имеющая, как правило, не-спаренных электронов.
Следует отметить, что из более 19 миллионов веществ, которые существуют в природе, подавляющее большинство, среди них около 18 миллионов органических, на самом деле имеют молекулярное строение. Поэтому понятие «молекула» и впрямь часто используется независимо от того, упоминает об этом автор или нет, как собирательный термин. Вместе с тем, несмотря на то, что количество, разнообразие неорганических веществ намного меньше, чем органических (чуть больше одного миллиона и многие из них имеют как раз немолекулярное строение), их общая масса многократно превышает массу органических веществ.
Так, например, есть вещества, которые состоят из отдельных атомов: гелий, аргон и другие благородные газы, входящие в состав воздуха. Правда, можно сказать и иначе: гелий и подобные по составу вещества представляют собой как бы одноатомные молекулы, т.е. здесь понятия молекулы и атома как бы совпадают. Условность такого подхода в данном случае зависит от договоренности, не более.
А вот про металлы (из 115 известных химических элементов 85 (74 %) относятся к металлам) также нельзя сказать, что они состоят из молекул.
Еще один пример – алмаз – самое твердое природное вещество. Секрет исключительной твердости алмаза, как установлено, состоит в том, что между атомами углерода возникает множество связей. Любую часть этого вещества – алмаз – по сути можно рассматривать как одну гигантскую молекулу по причине прочности связей.
В настоящее время получена температура –273,149999999 °С в системе атомов рубидия. Интересно, что эти самые атомы рубидия при такой сверхнизкой температуре конденсируются в одну плотную частицу – суператом.
Ассоциаты существуют чаще всего в газообразном состоянии и в растворах [(НСООН)2, H2F2], агрегаты – в твердом NaCl (тв.), Si (тв.) или жидком (эмульсии) состоянии.
В молекулярных ассоциатах могут возникать как сильные (специфические), так и слабые (неспецифические) взаимодействия между атомами различных молекулярных частиц. В случае сильных взаимодействий молекулярный ассоциат может рассматриваться как молекулярная частица, более сложная, чем исходные (НО2+НО2 → Н2О4). В случае слабых взаимодействий мы имеем дело с молекулярным ассоциатом, характеризующимся наличием надмолекулярной структуры.
Напомним, под структурой следует понимать закономерную пространственную организацию взаимодействующих частиц вещества, устойчивую в пространстве и во времени. Таким образом, различают следующие структурные уровни организации материи: ядерная структура, атомная структура, молекулярная структура, надмолекулярная структура. Трем последним структурам уделяется особое внимание в химии.
К атомно-молекулярным агрегатам относят молекулярные кристаллы (молекулярный агрегат), например HgCl2 (тв.), ионные кристаллы (атомно-ионные или молекулярно-ионные агрегаты), например NaCl (тв.), К1 (тв.) или NH4NO3 (тв.), атомные кристаллы (атомный агрегат), например Si (тв.), металлические кристаллы (атомно-ионный агрегат со «свободными» электронами) и др.
Молекулярные кристаллы – это агрегаты, образующиеся из молекул в результате слабых межмолекулярных взаимодействий (HgCl2, нафталин, I2 и т.д.). При нагревании они диссоциируют сравнительно легко на исходные молекулы. Однако для молекулярных кристаллов из крупных многоатомных молекул (красители, сахара и полисахариды и др.) эта особенность исчезает. Из-за большой энергии межмолекулярных взаимодействий в таких молекулярных кристаллах они не могут возгоняться, т.е. непосредственно переходить при нагревании из твердого в газообразное состояние (минуя жидкую фазу) без разложения.
Ионные кристаллы (ионные агрегаты) образуются из ионов вследствие сильных электростатических взаимодействий. Они плавятся и возгоняются, распадаясь на более простые частицы только при довольно высоких температурах. Распад ионных агрегатов на более простые частицы обычно легче осуществляется под воздействием полярного растворителя.
Несколько слов в этой связи о жидком состоянии. В настоящее время строение жидкостей выяснено только в самых общих чертах. Оно более сложно, чем строение газов или кристаллов. Жидкость как плотная нерегулярная структура более своеобразна, чем допускается квазикристаллическими представлениями с их близким и дальним порядком. Она имеет многочисленные и подвижные молекулярные образования (опять-таки, ассоциаты). В ней более благоприятные условия для обмена энергией и молекулярных перестроек.
Еще более сложное для описания и модельных представлений строение и структуру имеют растворы. Реальные растворы обладают молекулярной и надмолекулярной структурами. Дело в том, что сольватация – взаимодействие частиц (ионов, молекул и т.д.) растворенного вещества и растворителя – вызывает изменение состояния реагирующих частиц (образование сольватокомплексов, перераспределение зарядов, поляризацию, сольватационные эффекты и т.п.), а также приводит к созданию определенной среды, в которой протекают химические реакции или физико-химические процессы. Происходит изменение как структуры растворителя, так и структуры самих реагентов.
Подведем итог. Тела состоят из различных веществ. В земных условиях для вещества известно четыре состояния: твердые тела, жидкости, газы, плазма. Вещество как вид материи состоит, согласно представлениям современной физики, в конечном счете из фундаментальных частиц -кварков и лептонов. Руководствуясь же тем научным смыслом, который вкладывает в это понятие общее естествознание, мы должны признать и отнести к числу важнейших частиц вещества элементарные, атомные и молекулярные частицы, а также некоторые более сложные образования – продукты их ассоциации и агрегации – ассоциаты (иногда в литературе – группы, комплексы) и агрегаты.
4. Насколько малы молекулы?
Традиционно авторы школьных учебников рассказывают об одном из способов оценки размеров молекул (маслянистая жидкость на поверхности воды). Правда, надо заметить, что образование мономолекулярных слоев, т.е. толщиной в одну молекулу, происходит не всегда. Создание теории образования мономолекулярных слоев – сложная задача, за ее решение американскими учеными получена одна из Нобелевских премий. Далее авторами приводится пример на расчет того самого размера молекулы. Меняются коэффициенты численного значения размера молекул, неизменным остается порядок величины, 10–8 см. Некоторые авторы для усиления образности восприятия малости значения диаметра молекулы приводят соответствующие примеры.
«Молекула примерно во столько раз меньше яблока среднего размера, во сколько раз яблоко меньше земного шара». («Природоведение. 5 кл.», экспериментальный учебник. – Мн.: Национальный институт образования, 1999, стр. 25. Авторы: Л.З.Лисейчикова, В.В.Пугач, Е.И.Шарапа, Е.И.Шиманович.)
О других размерах и примерах речь не идет. Школьнику кажется, что размер всех молекул, как и размер любого атома (что как раз соответствует действительности), имеет один и тот же порядок.
Напомним, что впервые определил размер молекулы в 1865 году Н.Лошмидт. Он же, Лошмидт, нашел, что в 1 см атмосферного воздуха при нормальных условиях число молекул выражается числом, близким к 2,7∙1019. (Теперь это число называют числом Лошмидта.) А излагаемый обычно в учебниках метод оценки размеров молекул через площадь маслянистого пятна на поверхности воды принадлежит англичанину Рэлею.
Подобно тому как из одинаковых строительных блоков можно построить неодинаковые по размерам постройки, молекулы различных веществ также имеют разные размеры,, даже если они состоят из одинаковых атомов. Например, молекула белка гемоглобина (один из белков крови) имеет размер 68∙10–8 см в поперечнике (сравните с диаметром молекулы масла 4∙10–8 см). Мышечный белок (миазин) имеет размер в длину 1500∙10–8 см. А размеры молекулы некоторых ДНК (закручены в спираль, напоминающую веревочную лестницу, здесь заложена вся наследственная информация об организме, которая находится в ядре клетки), вообще достигают порядка миллиметра!
Обратимся в заключение к уже цитировавшемуся экспериментальному учебнику.
5. Что такое диффузия?
Почему-то школьные учебники определяют диффузию как явление взаимного проникновения соприкасающихся тел друг в друга, происходящее по причине беспорядочного движения их частиц. У Г.Я.Мякишева и Б.Б.Буховцева находим, что диффузия – перемешивание газов, жидкостей и твердых тел при непосредственном контакте (Физика, 10 кл. М.: Просвещение, 1997, стр. 11). Еще пример. В национальном белорусском учебном пособии «Физика, 7 кл.» (Исаченкова Л Б., Лещинский ЮМ. Мн.: Народная асвета, 1998) под диффузией понимают «самопроизвольное перемешивание молекул различных веществ при их соприкосновении».
Благодаря диффузии растения получают питание из почвы. Кислород из окружающей среды через кожу диффундирует в организм человека. В промышленности, диффузно обогащая поверхностный слой железа углеродом, значительно повышают твердость железа. Явление диффузии используют в производственных процессах: крашение тканей, дубление кож, засолка овощей и т.д. И что же здесь перемешивается и, тем более, взаимно проникает?
Если посмотреть на этимологию слова диффузия, от лат. diffusio – распространение, растекание, то все становится совсем определенным: не перемешивание, а распространение!
Во-вторых, совершенно не обязательно, чтобы диффузионными частицами были исключительно молекулы. Таким образом, диффузия – распространение вещества в какой-либо среде, обусловленное тепловым движением частиц (ионов, атомов, молекул, броуновских частиц). Пример немолекулярной диффузии – диффузия в тех же металлических гладко отшлифованных пластинках из золота и свинца, сложенных вместе, – классический пример из школьных учебников.
6. Благодаря ли диффузии ощущаем запах?
Несколько знакомых всем примеров из школьных (и не только) учебников.
В повседневной жизни часто приходится наблюдать такое явление, как распространение запахов, например, свежеприготовленного кофе из кухни, краски во время ремонта квартиры или цветов на лугу. Если в одном месте комнаты побрызгать духами, то через некоторое время мы будем ощущать их запах по всей комнате. Почему так происходит? И классический ответ: запахи леса, цветов, ягод, фруктов, краски, духов и т.п. доходят до нас благодаря ·.. диффузии. Но так ли это, собственно говоря?
В соответствии с формулой Эйнштейна – Смолуховского для описания движения броуновской частицы
где 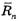 – среднее значение перемещения после n столкновений, υ – средняя скорость теплового движения, l – длина свободного пробега, t – время наблюдения.
– среднее значение перемещения после n столкновений, υ – средняя скорость теплового движения, l – длина свободного пробега, t – время наблюдения.
Эта формула справедлива и для частицы (молекулы) диффундирующего вещества, движущейся хаотически. Тогда при расстоянии в 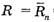 = 10 см = 10–1 м до источника запаха при обычных условиях (комнатная температура), чему соответствует υ = 100 м/с, l = 10–8 м (по порядку величины, т.е. длина свободного пробега на порядок-другой больше в среднем размера частиц воздуха),
= 10 см = 10–1 м до источника запаха при обычных условиях (комнатная температура), чему соответствует υ = 100 м/с, l = 10–8 м (по порядку величины, т.е. длина свободного пробега на порядок-другой больше в среднем размера частиц воздуха),
![]()
(Подробнее см.: Библиотечка «Квант», выпуск 5, стр. 85.)
Как видим, на вынесенный в заголовок вопрос надо дать отрицательный ответ. Основную роль при распространении запахов все же играет конвекция – движение потоков воздуха!
7. Окружающий воздух и наше представление о его строении
Как обычно описывается строение газов?
В газах расстояние между молекулами значительно больше, чем у жидкостей. Молекулы лишь изредка сталкиваются друг с другом.
Или, см. Г.Я.Мякишев, Б.Б.Буховцев. «Физика, 10 кл.», М.: Просвещение, 1997, § 5, § 6):
«В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул». В другом месте (стр. 17): «У разреженного газа расстояние между молекулами во много раз превышает их размеры». Сравнивая две последние цитаты, делаем вывод, что просто газы и разреженные газы ничем фактически не отличаются! В контрольном вопросе 2 к § 5 предлагается нарисовать учащимся траектории (выделено мной. -В.Ш.) движения молекул газа...
Известно, что расстояние (среднее) между молекулами газа очень сильно зависит от внешних условий: давления и температуры. Поэтому, говоря о нем (среднем межмолекулярном расстоянии), либо касаемся влияния этих условий, либо имеем в виду и об этом говорим совершенно конкретно, скажем, обычные, комнатные условия (чтобы специально не толковать так называемые нормальные условия) и в качестве газа – воздух (смесь газов). И тогда можно и стоило бы совершенно определенно сказать о порядке величины этого самого злополучного среднего расстояния между молекулами, чего вот уже на протяжении стольких лет старательно избегают авторы учебников. И тогда понимаешь, что остановленное мгновение, рисунок, показывающий расположение частиц газа (он обычно приводится рядом), не соответствует действительности: условия не оговорены, масштаб не соблюден. В конечном счете, запечатлевается ложный образ о строении газов. Хотя идеи и расчеты даже на уровне шестиклассника приводят к оценке этих самых расстояний, т.е. к результатам, сообщить которые физически (мы плохо представляем себе то, что нас окружает) и методически ценно.
К примеру, ссылаясь на опыт, указываем: газы, тот же воздух, легко сжимаются, его объем в технических устройствах уменьшают в десятки тысяч раз. Это означает, что при нормальном атмосферном давлении, обычной комнатной температуре объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул газов, из которых состоит воздух. Это вполне объяснимо, так как промежутки, расстояние между молекулами в среднем в 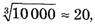 т.е. в несколько десятков раз больше размеров самих молекул!
т.е. в несколько десятков раз больше размеров самих молекул!
Оценку средних промежутков <r> между молекулами для «комнатных условий» можно сделать и исходя из концентрации молекул при этих комнатных условиях.
Если
рн = n∙k∙T,
где рн – нормальное атмосферное давление (1,01∙105 Па), n – число молекул в объеме V1 = 1 м3 – концентрация, T = 293 К – комнатная температура по шкале Кельвина, k – постоянная Больцмана (1,38∙10–23 Дж/К), тогда
![]()
Разделив единичный объем (1 м3) на объем всех молекул, содержащихся здесь, n∙V0, где V0 ≈ (0,3∙10–9)3 м3 ≈ 27∙10 – объем одной молекулы, определим превышение объема, приходящегося при данных условиях на одну частицу по сравнению с ее собственным объемом:
![]()
Полагая, что частица (молекула) находится в центре этого объема, и извлекая кубический корень из последней величины, выполняем приближенную оценку молекулярных промежутков для «комнатных условий»:
Если учесть, что силы взаимодействия молекул при увеличении расстояний между ними убывают, и если эти расстояния более чем в 10 раз превышают размеры молекул, эти силы уже ничтожно малы (практически равны нулю), то все становится понятным: молекулы газа движутся свободно и лишь при столкновениях сближаются так, что проявляются силы отталкивания, благодаря которым они меняют направления движения и опять движутся свободно до следующего столкновения. В результате газ не сохраняет ни объема, ни формы, а занимает весь предоставленный ему объем.
Правда, говоря о действии молекулярных сил, стоит отметить, что классическая физика пока не дала этому удовлетворительного объяснения. Чтобы их полностью понять, понадобилась квантовая механика. И ранее была ссылка на эмпирическую зависимость молекулярных сил как функцию расстояния между двумя молекулами (атомами).
Итак, при найденных промежутках взаимодействием между частицами воздуха можно пренебречь. Размеры частиц гораздо меньше того расстояния, на котором возможно их взаимодействие, т.е. эти частицы – материальные точки. Тогда, не интересуясь их структурой и формой, частицы воздуха просто и наглядно можно представить в виде твердых маленьких шариков и использовать эту модель при количественном описании свойств данного газа (смеси газов). По сути имеем дело с воздухом как с идеальным газом.
Удивительно, рис. 7 на стр. 15 цитировавшегося учебника физики для 10 кл. Г.Я.Мякишева и Б.Б.Буховцева передает наглядно строение воздуха как раз при «комнатных условиях» с учетом того, что размерами самих изображенных молекул не пренебрегаем: это для нас уже не материальные точки, а молекулы в определенном масштабе. Здесь среднее расстояние между молекулами-шариками приближенно равно 30 размерам молекул, т.е. масштаб является подходящим именно для «комнатных условий». Таким образом, повторимся, рис. 7 – идеальная картинка для заданных в рамках темы условий.
Можно показать, что в воздухе при обычных комнатных условиях, когда молекулы находятся в среднем на расстояниях в 20-30 десятков молекул, т.е. довольно значительных, тем не менее каждая из них испытывает в среднем за 1 с около миллиарда столкновений (!) друг с другом без учета соударений с элементарными частицами, наиболее вероятным из которых является взаимодействие с электронами. Существующее изменение величины напряженности электрического поля около поверхности Земли (от 100 В/м на поверхности до 25 В/м на высоте 1,5 км) позволяет оценить среднюю плотность электронов в атмосфере (порядка электронов в 1,1 см3 воздуха).
Чтобы понять, где лежит граница между макро- и микромиром, сделаем следующую оценку. Например, в опытах по броуновскому движению используются очень маленькие частички – размером около 1 мкм и массой всего 10–10 г. Но все-таки это кусочки вещества, содержащие огромное количество молекул (атомов). Из соотношения неопределенностей Гейзенберга в этом случае имеем:
![]()
Если, скажем, определять положение частички с точностью до одной сотой ее размера (Δх ~ 10–6см), то Δυx ~ 10–11 см/с. Получилась очень маленькая величина, и причина этого – малое значение постоянной Планка. (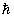 = 1,055∙10–34 Дж∙с.)
= 1,055∙10–34 Дж∙с.)
Скорость броуновского движения такой частички примерно равна 10–4 см/с. Как видно, погрешность в скорости, связанная с соотношением неопределенностей, пренебрежимо мала (одна десятимиллионная доля!) даже у такого небольшого тела. Тем более она не играет роли для больших тел (ведь в правой части соотношения стоит – 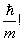 ).
).
А вот если мы будем уменьшать массу частицы (возьмем, например, молекулу азота воздуха) и увеличивать точность определения координаты (Δх ~ 10–10 м – молекулярно-атомные размеры), то неопределенность в скорости становится сравнимой по порядку с самой скоростью молекулы азота ~ 500 м/с при комнатных условиях:
![]()
то
![]()
Таким образом, еще раз, не только при рассмотрении коллектива из большого числа молекул, приходится пользоваться вероятностным описанием. Вероятностные закономерности могут определять поведение также отдельных членов коллектива, а именно: одного электрона, одного атома, одной молекулы. Вероятность здесь – математическое выражение необходимости, выявленной из массы случайностей. Удары молекул о стенки сосуда случайны, но нужна зависимость давления газа от его температуры (при заданном объеме). Скорости каждой молекулы – случайные величины, но необходима связь средней скорости поступательного движения и температуры. Расстояние между двумя соседними молекулами в воздухе имеет случайные значения, но требуется зависимость среднего значения этой величины от давления и температуры.
8. Состояние тел (системы) – тоже основное понятие физики!
Традиционно в начале изучения систематического курса физики вводятся основные понятия: «физическое тело» (система), «физическое явление», «физическая величина». Но среди этих понятий нет двух, на мой взгляд, достаточно важных, чтобы не отнести их к основным. Речь идет о состоянии и процессе. Между тем авторы всех без исключения учебников беззастенчиво пользуются названными понятиями, возможно, считая их само собой разумеющимися, что, конечно, не так. Тем более, что ряд состояний (и процессов) подлежит серьезному изучению: состояние невесомости, равновесия, наэлектризованности, намагниченности и др. Понятие состояния используем не только при описании агрегатных состояний или при рассмотрении перехода одного вида механической энергии в другой, т.е. из 1-й ступени курса, но и далее: газовые состояния в молекулярной физике, термодинамике при изучении теплового равновесия, наконец, систематически при решении соответствующих задач. Я не говорю уже о состоянии сверхпроводимости, состояниях атома, состоянии вакуума и еще около пяти десятков состояний, которым посвящены статьи в физической энциклопедии. Ежели попытаться обратиться к этим самым физическим словарям или даже физической энциклопедии, то удовлетворительного определения понятия «состояние» не встретим и там!
На доступном школьникам языке понятие состояния может быть введено примерно следующим образом (повторюсь, сделать это необходимо уже в самом начале систематического курса):
«Если в поведении тела (системы) ничего не изменяется, точнее, интересующая нас величина остается постоянной, то можно говорить о состоянии тела (системы). Так, например, можно описывать газообразное, жидкое или твердое состояние тел (вещества); состояние движения или покоя. В дальнейшем мы будем знакомиться с различными состояниями тел и их систем». Примерно таким образом.
9. Процесс или явление? или Что же все-таки такое процесс?
Не обойтись в школьном курсе физики и без раннего знакомства учащихся с понятием «процесс», которое также является основным и также не столь самоочевидно, как иногда кажется. То есть это не может служить авторам учебников оправданием для того, чтобы не определять это понятие. Школьники же чаще всего пользуются этим термином что называется бессознательно. В общем с понятием «процесс» все обстоит точно так, как и с тесно связанным с ним понятием «состояние». Подчеркну еще раз, оба понятия не столь просты и однозначны, как, возможно, принято считать. Современные выпускники средней школы не вполне владеют этими понятиями, и потому желательно начинать их формирование с самого начала изложения систематического курса физики.
Ранее (программа 80-90-х годов советской школы) в школьном курсе рассматривалось около 30 процессов. В новом национальном белорусском курсе «Физика, 8 кл.» (Исаченкова Л.A., Лещинский Ю.Д. Мн.: Народная асвета, 1999) уже изучается (определяется) 14 процессов: 1-4) теплопередача и три ее вида: теплопроводность, конвекция, излучение; 5) нагрев (охлаждение); 6) горение; .7-11) фазовые переходы (5 штук); 12) электризация; 13) намагничивание; 14) радиоактивный распад.
И тогда закономерно возникает вопрос: что же такое процесс? Опять-таки на адаптированном для школьников языке его понимание может выглядеть приблизительно так.
Под процессом понимают последовательное прохождение системой непрерывного ряда состояний, при этом непрестанно меняются физические величины, описывающие эти состояния. Пример: процесс движения – меняющиеся величины: координата, скорость, пройденный путь. Или см. процесс совершения механической работы или фазовые переходы.
Явление – как любое изменение, происходящее с физическими телами – является в этом смысле более широким понятием, вместе с тем, как видим, часто синонимичным с родственным понятием «процесс».
10. Фаза – часть среды или состояние вещества? Фазовые переходы или агрегатные превращения? Давайте разберемся !
Некоторые авторы школьных учебников при описании физических свойств веществ используют понятие фазы и фазовых переходов. У учителей, уже подзабывших вузовский курс физики, это вызывает некий страх и, соответственно, негодование и противодействие. И есть отчего. Слишком по-разному подходят авторы к толкованию фазы. Ни на что не претендуя, обратим внимание на сопутствующие этому проблемы.
Просматриваются два подхода (нечто подобное с инерцией в механике): с одной стороны, фаза как часть среды. Отсюда, кстати, и возникают наибольшие сложности. Так, в школьном учебном пособии «Физика, 8 кл.» (Исаченкова Л.A., Лещинский Ю.Д. Мн.: Народная асвета, 1999) фаза определяется как «область пространства, физические свойства которой одинаковы по всему объему». Но пространство может быть и пустым! К тому же эта самая область должна быть ограничена поверхностью раздела, иначе в слое над поверхностью жидкости (см. рис.), где плотность водяного пара больше, можно говорить о существовании еще одной фазы и тогда фаз в стакане оказывается три вместо двух. Или с таким же успехом фазами можно назвать условно выделенные слои земной атмосферы в связи с изменением давления (плотности) с высотой.
С другой стороны, фаза как состояние вещества, характеризуемое неизменностью физических свойств по всему объему, отличающееся от других равновесных состояний того же вещества, что более предпочтительно. Раз есть фазовые переходы, то разумнее было бы говорить о фазе именно как о состоянии вещества.
Однако вопрос: одинаковой ли внутренней энергией обладает одна и та же масса вещества при одинаковой температуре, но в различных фазах – не всегда правомерен.
Так как можно неожиданно ответить «Да!», если мы имеем дело с фазовыми переходами 2-го рода (а ведь они тоже вошли в определение фазовых переходов!). В качестве контр-примера можно привести такой фазовый переход 2-го рода: переход ферромагнетиков в парамагнитное состояние. Сам же фазовый переход 2-го рода, происходящий, как отмечалось, непрерывным образом, характеризуется аномальным возрастанием флуктуационных (случайным образом отклоняющихся от нормы) явлений, которые, в свою очередь, характеризуются набором флуктуирующих величин (случайным образом отклоняющихся от их средних значений). Рост таких флуктуации (случайных отклонений) приводит к ряду аномалий в поведении системы (возможно, к критическим явлениям). Примеры: возникновение турбулентности в жидкостях и газах; появление ложных сигналов-шумов на выходе усилителей электрических сигналов.
P.S. После «кочующих» ошибок в темах «Основные понятия молекулярной теории строения вещества» и «Фазовые переходы» вас ждет «Механика» и ее школьные заблуждения.
| Выложил | |
| Опубликовано | 01.08.16 |
| Просмотров | 6319 |
| Рубрика | Методика | Материалы к уроку |
| Тема | МКТ Термодинамика |